Medicatiewisseling
- De productie en levering van hydrocortison en fludrocortison vallen sinds medio 2020 onder het Geneesmiddelenvergoedingssysteem (GVS).
- Dit heeft consequenties voor de patiënten die deze medicatie gebruiken, de behandelend artsen verpleegkundig specialisten en de apothekers.
- De behandeling van mensen met bijnierschorsinsufficiëntie met hydrocortison luistert heel nauw.
- Wisselen van hydrocortison tablet of capsule is niet gewenst
- Staat uw vraag er niet bij, zend dan een mail naar info@bijniernet.nl.
 Een themapagina verzamelt relevante informatie over een onderwerp.
Een themapagina verzamelt relevante informatie over een onderwerp.
Bijnierschorsinsufficiëntie en substitutietherapie?
Bijnierschorsinsufficiëntie is een aandoening waarbij de aanmaak van cortisol door de bijnier is verminderd. Patiënten gebruiken hydrocortisontabletten of -capsules met het doel dit hormoon aan te vullen tot normale hoeveelheden in het bloed. Dit noemt men substitutietherapie.
Met verschillende doseringen en innamemomenten op de dag wordt geprobeerd zoveel als mogelijk het natuurlijke proces na te bootsen. Iedere patiënt is weer anders en het luistert heel nauw. Een juiste en betrouwbare dosering en beschikbaarheid van medicatie is belangrijk omdat wisselen van hydrocortisonmedicatie niet gewenst is. Wisselen van medicatie kan klachten veroorzaken, ongeacht het medicijn dat wordt gebruikt.
Soms moet een patiënt toch over op andere medicatie en dan is een goede samenwerking tussen de behandelend specialist, apotheker en patiënt belangrijk.
Aan de hand van vragen&antwoorden, treft u hieronder meer informatie aan.
Veelgestelde vragen en antwoorden
Hydrocortison is een medicijn met een zogenaamde smalle therapeutische breedte. Goed ingesteld raken luistert heel nauw. Het vraagt doorlooptijd omdat het lichaam moet wennen en de patiënt signalen van het lichaam moet leren begrijpen.De juiste dosis is voor iedere patiënt anders en wisselen van medicijnen kan hierdoor dan ook klachten geven van zowel onder- en overdosering. Beide situaties zijn niet gewenst. Dat is de reden dat de behandelend specialist extra alert is bij medicijnwisselingen.
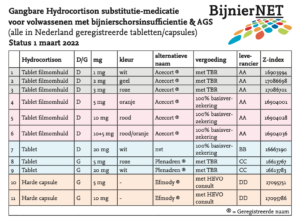
Tot enige jaren geleden waren alleen Plenadren 5 en 20 mg, witte 20 mg hydrocortison tabletten van Tiofarma en Florinef® geregistreerd bij het CBG.
Alle andere varianten van hydrocortison en fludrocortison waren niet geregistreerd en alleen leverbaar als doorgeleverde bereidingen.
Sinds 2020 zijn tabletten met lage hoeveelheden werkzame stof hydrocortison en fludrocortison geregistreerd bij het CBG, juist bedoeld voor substitutietherapie.
De tabletten zijn ontwikkeld en geproduceerd aan de hand van de Kwaliteitsstandaard Bijnieraandoeningen, dat wil zeggen: gecoat, een vaste kleur per sterkte, juiste sterktes geschikt voor dagelijkse substitutie-therapie en in strips én geregistreerd. Helaas heeft dit ook gevolgen voor de kosten van medicijnen. Hieronder lichten we alle veranderingen toe.
Coating
Patiënten gaven bij aanvang van het ontwikkelproces aan last te hebben van een nare nasmaak van de oude tabletten, een smaak die lang kon duren na inname van de tablet hydrocortison, vandaar een coating.

Kleur
Bovendien waren tabletten met verschillende sterktes niet eenvoudig te onderscheiden van elkaar met het risico op verkeerde innames op de dag. Vandaar dat de tabletten in kleur zijn uitgevoerd mede op het verzoek van de internisten-endocrinologen en apothekers.
Lage sterktes voor substitutie-therapie
Breken van de tabletten bij substitutie-therapie is ongewenst. Dat hoort tot het verleden. Met 1, 2, 3, 5 en 10 mg hydrocortison kunnen de meeste patiënten hun medicatie-afspraak uitvoeren. De hoeveelheid werkzame stof is in de tablet gestanst.
Tijdelijk moet de tablet fludrocortison 62,5 microgram wél gebroken worden, omdat het registratieproces van 31,25 microgram nog niet was afgerond. De breekkwaliteit van de tablet was daarom verbeterd. Vanaf september 2022 is de tablet 31,25 microgram fludrocortison beschikbaar.
Strips
De medicijnen hydrocortison worden in strips geleverd om een hoge kwaliteit van de tablet voor langere tijd te waarborgen.
Bijbetaling
De 1, 2, 3, 5 en 10 mg hydrocortison vallen volledig onder de vergoeding vanuit het basispakket van de zorgverzekeraars.
Er is een eigen bijdrage-regeling van toepassing op een deel van de medicatie die mensen met bijnieraandoeningen gebruiken. Het betreft:
* Plenadren® 5 mg en 20 mg,
* Fludrocortison 31,25 microgram en 62,5 microgram tabletten
* Capsules Efmody® 5 mg en 10 mg.
Het is verstandig dat de behandelend arts en patiënt samen de wisseling van de medicijnen bespreken, zeker wanneer patiënten bekend zijn met onverwachte bijwerkingen. Zij maken gezamenlijk een goede afspraak over het wisselen en eventueel verandert de arts het voorschrift voor de medicatie als hiermee problemen voorkomen kunnen worden. De behandelend arts legt goed uit wat over- en onderdosering betekent voor de patiënt en checkt of de patiënt dit goed heeft begrepen. Het is vervolgens ook belangrijk dat de apotheker de patiënt goed informeert.
Het is voor de gezondheid van de patiënt op lange termijn belangrijk dat voldoende hydrocortison wordt ingenomen met tabletten of capsules. Dus: niet teveel en niet te weinig. Dit wordt overdosering en onderdosering genoemd. Dit worden instelproblemen genoemd.
Onderdosering kan leiden tot: moeheid, duizeligheid, misselijkheid, spierzwakte, buikpijn, diarree en concentratiestoornis. Later kan een bijniercrisis ontstaan.
Overdosering kan leiden tot: gewichtstoename, hoge bloeddruk en slaapstoornis.
Het vraagt training door de patiënt om te voelen of ‘het goed’ zit. De patiënt kent zijn lichaam het beste.
De behandelend arts kan een extra recept voorschrijven voor 1 mg hydrocortison zodat de patiënt tijdelijk een kleine hoeveelheid hydrocortison kan innemen bij een gevoel van onderdosering.
De vulstoffen in de tabletten hydrocortison zijn: lactose monohydraat, natriumzetmeelglycolaat, magnesiumstearaat, polivinylalcohol, titaniumdioxide, macrogol (PEG) en talk.
De vulstoffen in de tabletten fludrocortison zijn: Lactosemonohydraat, maiszetmeel en magnesiumstearaat.
Van de gebruikte vulstoffen is bekend dat zij heel zelden overgevoeligheidsreacties veroorzaken. Voor bijna alle medicatie in Noord-West Europa worden deze vulstoffen gebruikt, dus ook de bekende doorgeleverde bereidingen.
Bij een kleurstofallergie kunnen de witte 1 mg of de 20 mg tabletten hydrocortison worden gebruikt of de hydrocortisondrank.
Bij een ernstige lactose-allergie moet vermoedelijk overgegaan worden op de hydrocortisondrank. Bijna alle tabletten in Noord-West Europa bevatten immers lactose. Daarom zijn patiënten die een ernstige lactose-allergie hebben over het algemeen met deze problemen bekend omdat dit voor veel andere medicatie ook het geval is. Bij dergelijke problemen is goed dat de behandelend arts, de apotheker en de patiënt samen beslissen over een alternatief.
In principe is het niet meer mogelijk om hydrocortisontabletten op de markt te brengen als doorgeleverde bereiding met eenzelfde dosering hydrocortison. In specifieke gevallen kan worden uitgeweken naar een op maat gemaakt medicijn. Een duidelijke verslaglegging van de reden van uitwijken is vereist. De apotheker zal vooraf in overleg treden met de zorgverzekeraar van de patiënt over de vergoeding van de individuele bereiding.
Het betekent dat de patiënt moet bijbetalen voor in dit geval medicatie en dat het wordt terugbetaald via een daarvoor in het leven geroepen stichting.
Het Nederlandse zorgstelsel kent een eigen risico voor de zorgkosten die een patiënt zelf moet betalen. Dit bedrag is vastgesteld op maximaal €385/jaar/verzekerde.
Naast dit eigen risico kent het stelsel ook een eigen bijdrage per verzekerde. Per jaar is de eigen bijdrage maximaal €250.
De terugbetaalregeling geldt voor de volgende medicijnen:
* Plenadren® 5 mg en 20 mg, via TBR Nederland.
* Fludrocortison 31,25 microgram en 62,5 microgram tabletten via TBR Nederland.
* Capsules Efmody® 5 mg en 10 mg, via HEVO consult.
Uitsluitend de patiënt of de verzorger kunnen eigen bijdragen declareren bij TBR Nederland of HEVO consult. De apotheker kan dit niet namens de patiënt doen. De patiënt betaalt uiteindelijke niets extra; er is wel een administratieve handeling bijgekomen en het bedrag moet voorgeschoten worden.
 TBR Nederland adviseert om online de eigen bijdragen terug te vragen. De patiënt maakt daarvoor een account aan en kan op deze manier de formulieren en het gespecificeerde overzicht van de zorgverzekeraar uploaden. Per post declareren kan ook, maar duurt wat langer.
TBR Nederland adviseert om online de eigen bijdragen terug te vragen. De patiënt maakt daarvoor een account aan en kan op deze manier de formulieren en het gespecificeerde overzicht van de zorgverzekeraar uploaden. Per post declareren kan ook, maar duurt wat langer.
Het stappenplan om de eigen bijdrage terug te vragen.
De voorschrijver vermeldt op het recept welk ‘merk’ en het juiste Z-index nummer van het medicijn om wisselingen tussen merk of fabrikant bij afleveringen te voorkomen.
Per 1 januari 2024 is er een verplichting om een voorraad aan te leggen van 6 weken voor wandelvergunninghouders en van 2 weken voor groothandelaren.
Het advies voor patiënten is om de medicatie op tijd te bestellen en te zorgen dat er minimaal voor 1 maand medicatie in huis heeft.
Patiënten en artsen waren het eens over het feit dat de medicinale behandeling van mensen met een bijnierziekte zorgelijk was. Voor de substitutie van cortisol was slechts één medicijn van 20 mg geregistreerd en alle andere varianten werden op uiteenlopende manieren op de markt gebracht in verschillende sterkten. De internisten-endocrinologen en apothekers maakten zich zorgen over de therapietrouw en de medicatiefouten. Oorzaken: pillen zijn niet te onderscheiden, breken leidt tot onnauwkeurigheid en de smaak beïnvloedt de kwaliteit van leven de patiënt die deze pillen levenslang moet gebruiken.
Een registratie van de medicijnen zorgt leidt tot een betere controle op de productie, ontwikkeling en levering ervan.
Handige links
Deze webpagina is aangemaakt op 17 augustus 2020 onder auspiciën van het bestuur van BijnierNET. De aanleiding is de veranderingen in de productie en levering van hydrocortison en fludrocortison t.g.v. registratie van de medicatie bij het CBG. Februari 2021, augustus 2022 en december 2024 is de Q&A uitgebreid en aangepast.


 De themapagina Medicatie verzamelt alle informatie over medicijnen voor mensen met een bijnieraandoening, het recept, de kosten, terugbetalingen en het melden van onverwachte bijwerkingen.
De themapagina Medicatie verzamelt alle informatie over medicijnen voor mensen met een bijnieraandoening, het recept, de kosten, terugbetalingen en het melden van onverwachte bijwerkingen.